Microsporidiose : sur les traces des maladies émergentes humaines de demain avec le projet MicroMonkey
Publié par Université de Tours, le 21 mars 2022 1.6k
Le concept est encore mal connu… il est pourtant fondamental dès que l’on se penche sur les questions de santé publique mondiale ou des infections de demain. One Health est une approche qui entend en effet regrouper tous les pans de la santé, qu’ils soient humain, animal ou environnemental, sous une seule et même bannière.
Il aura fallu attendre le milieu des années 2010 pour voir enfin la communauté scientifique reconnaître sa pertinence, par sa capacité notamment à prendre en compte une multitude de problématiques. Parmi ces dernières, le risque microbiologique tient une place à part : les événements récents ont prouvé l’impact des agents infectieux (virus, parasites…) lorsqu’ils deviennent capables de franchir la barrière d’espèce et de passer de leur hôte habituel (singe, chauve-souris, etc.) à un nouveau – en l’occurrence l’être humain. On peut multiplier les exemples…
La pandémie de Covid-19, qui en deux ans a frappé plus de 450 millions de personnes dans le monde, semble avoir pour origine un coronavirus de chauve-souris. Qui, pour atteindre notre espèce, a pu utiliser un hôte intermédiaire – possiblement un autre mammifère, consommé illégalement en Asie du Sud-Est.
La grippe saisonnière est, elle, causée par des virus infectant humains, porcs et oiseaux qui échangent des fragments de leur matériel génétique (on parle de recombinaison). Des espèces de parasites responsables du paludisme chez les singes semblent pouvoir aussi gagner notre espèce. Certaines épidémies dues à des infections fongiques rares, comme l’histoplasmose ou la coccidioïdomycose, surviennent après des perturbations de l’environnement d’origine humaine : travaux d’aménagement de grottes, déblaiement, constructions de routes…
Ces quelques situations illustrent l’impact critique que peuvent avoir dérèglement climatique, mondialisation ou encore proximité animale sur la santé publique, en bouleversant les territoires et interactions classiques entre espèces. Pour mieux appréhender la complexité des (éco)systèmes qui nous entourent, et prévenir ainsi le risque de survenue d’épidémie ou de pandémie, le décloisonnement de la science paraît évident.
C’est là que le concept One Health prend tout son sens.
La microsporidiose, une infection sous-estimée
En dépit de ce constat, nombre de maladies émergentes sont négligées. Les données scientifiques à leur sujet demeurent lacunaires malgré un potentiel zoonotique (leur capacité de passer de l’animal à l’Homme ou inversement) reconnu. La microsporidiose fait partie de ces infections sous-estimées, pour lesquelles les moyens mis à disposition de la recherche et de la médecine restent limités.
La microsporidiose est une maladie du tube digestif, causée par l’absorption alimentaire ou hydrique de champignons microscopiques, appelés microsporidies. Les principaux signes cliniques sont de graves diarrhées et une déshydratation. Elle concerne préférentiellement le sujet fragilisé (suite à une transplantation d’organe, souffrant de leucémie, du VIH) et, dans une moindre mesure, l’enfant ou le voyageur.
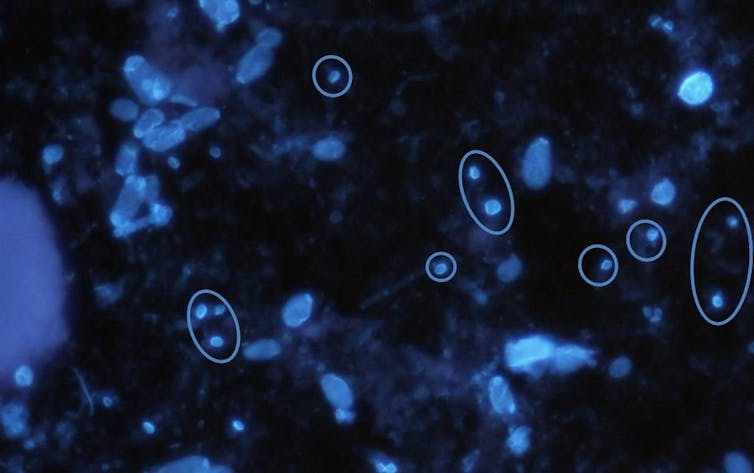
En France métropolitaine, l’incidence de la microsporidiose reste certes rare, avec 100 à 200 nouveaux cas notifiés par an au réseau national de surveillance. Mais dans les régions subtropicales et les pays à faibles ressources, les taux de prévalence peuvent être largement supérieurs. On estime ainsi que 15 à 20 % de la population locale y est porteuse de microsporidies.
On sait déjà – mais de façon non exhaustive et mal documentée – que les animaux domestiques ou les bêtes de rente participent activement au cycle infectieux de la microsporidiose. Et il reste beaucoup à explorer du côté des réservoirs sauvages ou semi-sauvages avec lequel certaines populations sont en contact toujours plus rapprochés. Différents phénomènes supportent cette hypothèse : déforestation, urbanisation, braconnage, tourisme de masse…
Décrire le cycle infectieux de la microsporidiose en étudiant les espèces hôtes (semi)-sauvages dans leur milieu naturel aiderait à anticiper le risque d’épidémies. Obtenir davantage de données de terrain nous permettrait de mieux prévenir le passage à l’Homme, en adaptant les messages prophylactiques ou en mettant en place différents outils de surveillance.
Un projet pour remonter aux sources des parasites méconnus
Pour répondre à ces objectifs, le service de Parasitologie-Mycologie-Médecine tropicale du centre hospitalo-universitaire de Tours, avec la direction de la recherche et de l’innovation de l’hôpital et la vice-présidence en charge des relations internationales de l’université de Tours, met en place le projet MicroMonkey . Il s’agit d’une étude prospective multicentrique (se déroulant sur plusieurs sites et plusieurs années) qui s’intéresse à la microsporidiose chez les grands singes d’Afrique.
En effet, gorilles et chimpanzés présentent d’importantes homologies avec notre espèce, tant génétiques que physiologiques, et une répartition géographique qui tend à se superposer toujours plus à celle des populations humaines. Changements environnementaux et comportementaux sont largement en cause. Il est donc pertinent de penser que ces primates pourraient jouer un rôle dans le cycle infectieux de la microsporidiose.
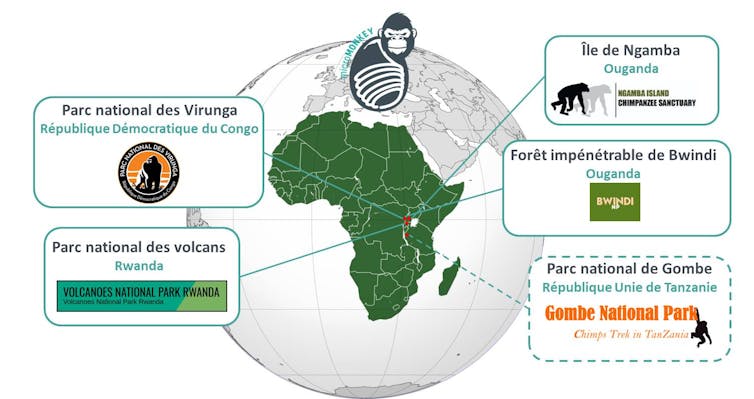
Dans les quatre à cinq ans à venir, nous projetons donc de collecter longitudinalement (de façon continue, sur les mois à venir) des selles de primates dans plusieurs réserves naturelles de quatre pays d’Afrique de l’Est – la République démocratique du Congo, l’Ouganda, le Rwanda et la République Unie de Tanzanie.
Nous interviendrons directement dans les parcs nationaux pour récupérer les échantillons qui seront d’abord stockés et traités sur place, puis exportés en France pour des analyses moléculaires.
En parallèle, des selles de primates seront collectées dans plusieurs parcs animaliers européens (Barcelone, Londres, Budapest, Rotterdam, Anvers, Berlin ou en France au Zoo de La Flèche, BioParc de Doué-la-Fontaine, ZooParc de Beauval). Confronter les résultats obtenus à partir des populations sauvages et des groupes placés sous soins humains nous permettra d’évaluer le niveau de portage relatif des microsporidies. Il sera aussi possible de mesurer la représentativité des différentes souches et leur circulation.
Ces données seront également mises en perspective avec celles de singes non humanoïdes (babouins, colobes, singes vervet). Elles pourront encore être comparées avec celles provenant de prélèvements fécaux d’origine humaine transmises par le réseau national de surveillance de la microsporidiose.
Enfin, la composition du microbiote digestif des singes sera analysée par séquençage haut débit. Nous pourrons repérer quels genres microbiens se trouvent sur ou sous-représentés au sein de leur flore intestinale, afin d’appréhender les éventuels impacts de la microsporidiose sur leur santé.
Une approche transposable pour d’autres maladies
Le projet MicroMonkey se veut être un modèle d’étude extrapolable à d’autres infections émergentes zoonotiques.
Nous cherchons à mieux comprendre l’épidémiologie de la microsporidiose et de dépeindre avec précision son réservoir animal. Notre étude pourrait aider à sensibiliser les autorités et le grand public sur plusieurs points sensibles, de la conservation de la nature à la préservation des espèces menacées. Et à la probabilité des contaminations interespèces…
En fonction de nos découvertes, des propositions pourront être formulées pour tenter de limiter de futures émergences : programmation de dépistage systématique, traitement anti-infectieux prophylactique, création de latrines ou interdiction de l’épandage humain en Afrique, etc.
Pour fédérer le réseau des centres participants au projet MicroMonkey, des actions préliminaires ont déjà débuté sur le terrain. Elles vous seront détaillées dans un prochain épisode.
Guillaume DESOUBEAUX, Professeur, Université de Tours
Cet article est republié à partir de The Conversation sous licence Creative Commons. Lire l’article original.




